Tiefe Hirnstimulation bei der Alzheimer-Krankheit
Bei der Tiefen Hirnstimulation (engl.: Deep Brain Stimulation, DBS) werden dem Patienten dünne Elektroden (zumeist) in beide Gehirnhälften implantiert, die über subkutan verlegte Kabel mit einem Impulsgeber im Schulterbereich oder im Oberbauch verbunden sind. An die stereotaktisch positionierten Elektroden wird eine permanente hochfrequente (ca. 180 Hz) gepulste (ca. 100 ms Dauer) Spannung (ca. 1,5 V) angelegt. Dadurch wird die Zielregion im Gehirn abhängig von der Frequenz entweder deaktiviert oder stimuliert.
Die DBS stellt für fortgeschrittene Stadien des Morbus Parkinson sowie des essenziellen Tremors mittlerweile eine klinische Standardtherapie dar. Sie führt zu einer erheblichen Besserung der Symptome, insbesondere von Tremor (Zittern) und Rigor (Muskelsteife). Wegen des beeindruckenden Erfolgs der DBS bei der Parkinson-Erkrankung befindet sich derzeit eine Reihe weiterer klinischer Indikationen in der klinischen Testung, z. B. Zwangsstörung, Tourette-Syndrom, Epilepsie, Depression, chronische Schmerzsyndrome; aber auch Suchterkrankungen und Essstörungen. Einige vorläufige Ergebnisse aus diesen Studien deuten darauf hin, dass sich die Indikationsstellung für die DBS in den kommenden Jahren erweitern und die Stimulation weiterer Zielstrukturen hinzutreten wird. Dabei zeichnet sich die DBS insbesondere durch ihre Reversibilität und die nachträgliche Adaptierbarkeit der Stimulationsparameter gegenüber früher verwendeten läsionellen Verfahren aus.
Im Zuge der Untersuchung neuer Indikationen für die DBS ergeben sich jedoch grundlegende Probleme, welche bislang nur unzureichend gelöst sind. Dies gilt insbesondere für (i) die Definition eines geeigneten Stimulationsortes sowie (ii) eine valide Methode der Überprüfung des Stimulationserfolges. Anders als bei der Parkinsonerkrankung lassen sich bei den anderen genannten Erkrankungen nicht unmittelbar mit Stimulationsbeginn (also noch während der Operation) die Effizienz der Sondenlage und ihre klinische Wirksamkeit überprüfen.
Verfahren der molekularen und funktionellen Bildgebung haben das Potenzial, bei der Lösung der genannten Probleme eine wichtige und hilfreiche Rolle zu spielen. Die Positronen-Emissionstomographie (PET) bietet die Möglichkeit, metabolische Veränderungen des Hirngewebes unmittelbar um den aktiven Kontakt (Naheffekt) sowie in entfernten Hirngebieten unmittelbar abzubilden. Mittels PET können die Durchblutung ([15O]H2O), Zuckerstoffwechsel ([18F]FDG) und auch die Verteilung und Dichte verschiedener Rezeptorproteine für Neurotransmitter gemessen werden.
Im Rahmen einer klinischen Prüfung, welche federführend von den Universitätskliniken für Stereotaxie und Psychiatrie der Universität Köln durchgeführt wurde, haben wir dieses Verfahren bei Patienten angewendet, die an der Alzheimer-Krankheit litten. Die Elektroden wurden beidseits in den Nucleus basalis Meynert, ein Kerngebiet im basalen Vorderhirn, welches das Großhirn mit dem Neurotransmitter Acetylcholin versorgt, eingesetzt. Ziel der lokalen Neurostimulation dieser Zellgruppe sollte eine erhöhte Freisetzung von Acetylcholin im Großhirn dieser Patienten und damit eine Verbesserung des Gehirnstoffwechsels sein.
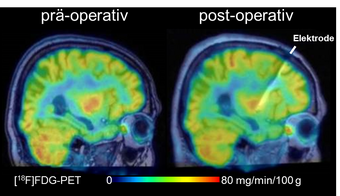
Abbildung: Überlagerung von sagittalen Ebenen aus den MRT- und PET-Untersuchungen eines Patienten der Studie zur Tiefen Hirnstimulation bei M. Alzheimer (links: vor Operation; rechts 8 ½ Monate nach Operation unter permanenter Niederfrequenz-Stimulation). Der Patient (67 Jahre, ca. 3 Jahre andauernder Krankheitsverlauf) zeigte eine klinische Besserung, welche mit dem hier durch Fehlfarben dargestellten, bemerkenswert stabilen, regional sogar leicht erhöhten Glukosestoffwechsel der Hirnrinde korrespondiert.
Zwölf Monate nach Therapiebeginn zeigten die Patienten teils stabile, teils verbesserte Parameter. Vier der sechs Patienten zeigten ein Ansprechen auf die Therapie in Gestalt von klinischen, neuropsychologischen und lebensweltlichen Verbesserungen. Wir haben den Gehirnstoffwechsel der Patienten vor der Operation und nach einem Jahr Niederfrequenzstimulation (30 Hz) mittels [18F]FDG-PET untersucht. Als Ausdruck des fortschreitenden Funktionsverlustes der betroffenen Hirnzellen nimmt der Glukosestoffwechsel bei Alzheimer-Patienten in der Regel pro Jahr um etwa 5 % ab. Bei den Patienten, die klinisch auf die DBS ansprachen, kam es jedoch zu einem Stillstand dieser Entwicklung, so dass sie unter DBS keine weitere Reduktion ihres Gehirnstoffwechsels zeigten.
Aus wissenschaftlicher Sicht fand sich zudem ein zu diesem „Ferneffekt“ korrespondierender lokaler Befund an den Elektrodenspitzen. Hier zeigte sich in einer Zone um den aktiven Kontakt ein leichter Anstieg des Glukoseverbrauchs unter eingeschalteter Stimulation. Dieser Befund belegt eindrücklich, dass eine niederfrequente Stimulation tatsächlich zu einer Aktivierung von metabolischen Prozessen führt.
